OBSERVA EL SIGUIENTE VIDEO
| A través de los sentidos (vista, oido, tacto, gusto y olfato) recibimos y percibimos información sobre todo lo que nos rodea. Percibimos objetos de diversas clases, formas, tamaños, gustos y olores. Todos estos objetos que nos presenta la naturaleza están formados por materia, ocupando un lugar en el espacio. | |||||||||||||||||||||
 | |||||||||||||||||||||
| La naturaleza nos presenta la materia bajo tres estados: sólido, líquido y gaseoso. Aqui abajo podemos ver los materiales anteriormente expuestos ordenados según el estado en que se encuentran. | |||||||||||||||||||||
| |||||||||||||||||||||
| La materia está formada por pequeñas partículas. Según sea la fuerza de la unión de estas partículas se encontrará en estado sólido, líquido o gaseoso. | |||||||||||||||||||||
| |||||||||||||||||||||
| Dentro del amplio apartado de la materia, nos encontramos con los estados de la materia (sólidos, líquidos y gases) sus propiedades y los cambios que hay en la materia. Esto es lo que veremos en esta entrada. Bienvenido al mágico mundo de la materia EJERCICIO | |||||||||||||||||||||
RESPONDE ENTONCES..........EL AIRE ES MATERIA?.....DIFICIL?........OBSERVA LOS SIGUIENTES EXPERIMENTOS Y CONCLUYE
 | |||||||||||||||||||||
CONCENTREMONOS AHORA EN LOS ESTADOS DE LA MATERIA
| Estado sólido |
Los sólidos se caracterizan por tener forma y volumen constantes. Esto se debe a que las partículas que los forman están unidas por unas fuerzas de atracción grandes de modo que ocupan posiciones casi fijas. En el estado sólido las partículas solamente pueden moverse vibrando u oscilando alrededor de posiciones fijas, pero no pueden moverse trasladándose libremente a lo largo del sólido. Las partículas en el estado sólido propiamente dicho, se disponen de forma ordenada, con una regularidad espacial geométrica, que da lugar a diversas estructuras cristalinas. Al aumentar la temperatura aumenta la vibración de las partículas |
2. LÍQUIDOS
| Estado líquido |
Los líquidos, al igual que los sólidos, tienen volumen constante. En los líquidos las partículas están unidas por unas fuerzas de atracción menores que en los sólidos, por esta razón las partículas de un líquido pueden trasladarse con libertad. El número de partículas por unidad de volumen es muy alto, por ello son muy frecuentes las colisiones y fricciones entre ellas. Así se explica que los líquidos no tengan forma fija y adopten la forma del recipiente que los contiene. También se explican propiedades como la fluidez o la viscosidad. En los líquidos el movimiento es desordenado, pero existen asociaciones de varias partículas que, como si fueran una, se mueven al unísono. Al aumentar la temperatura aumenta la movilidad de las partículas (su energía). |
3. GASES
Los gases, igual que los líquidos, no tienen forma fija pero, a diferencia de éstos, su volumen tampoco es fijo. También son fluidos, como los líquidos.
En los gases, las fuerzas que mantienen unidas las partículas son muy pequeñas. En un gas el número de partículas por unidad de volumen es también muy pequeño.
Las partículas se mueven de forma desordenada, con choques entre ellas y con las paredes del recipiente que los contiene. Esto explica las propiedades de expansibilidad y compresibilidad que presentan los gases: sus partículas se mueven libremente, de modo que ocupan todo el espacio disponible. La compresibilidad tiene un límite, si se reduce mucho el volumen en que se encuentra confinado un gas éste pasará a estado líquido.
Al aumentar la temperatura las partículas se mueven más deprisa y chocan con más energía contra las paredes del recipiente, por lo que aumenta la presión:
En los gases, las fuerzas que mantienen unidas las partículas son muy pequeñas. En un gas el número de partículas por unidad de volumen es también muy pequeño.
Las partículas se mueven de forma desordenada, con choques entre ellas y con las paredes del recipiente que los contiene. Esto explica las propiedades de expansibilidad y compresibilidad que presentan los gases: sus partículas se mueven libremente, de modo que ocupan todo el espacio disponible. La compresibilidad tiene un límite, si se reduce mucho el volumen en que se encuentra confinado un gas éste pasará a estado líquido.
Al aumentar la temperatura las partículas se mueven más deprisa y chocan con más energía contra las paredes del recipiente, por lo que aumenta la presión:
OBSERVA ESTE VIDEO SOBRE LAS PROPIEDADES DE LA MATERIA
| Forma: la materia tiene una determinada forma dependiendo del estado en que se encuentre. Masa: es la cantidad de materia que posee un cuerpo. Lo medimos en kilogramos (Kg) también en gramos(g) si es pequeño. Volumen: es el espacio que ocupa un cuerpo. Lo medimos en metros cúbicos (m3) en centímetros cúbicos(cm3) si es pequeño. Como ya viste la materia, tiene propiedades generales y propiedades especificas.....Profundicemos
Asigna a cada situación el cambio de estado que se está produciendo. |
|
|
MAS ACERCA DE LOS CAMBIOS DE LA MATERIA
Simulación: (pulsa el botón para encender el mechero y observa los cambios) |
| Para hacer una mezcla sólo tenemos que unir dos o más sustancias. En la naturaleza, los materiales suelen ir mezclados. Al realizar cualquier mezcla los materiales no se alteran. Mezclar es fácil, separar la mezcla no tanto.
| ||||||||||||||||||||||||||||||||||||||||||||||||||
Las mezclas pueden ser homogéneas y heterogéneas.
| ||||||||||||||||||||||||||||||||||||||||||||||||||
Practica este tema con las actividades de este enlace | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Como se ha dicho anteriormente, separar las mezclas no es tan sencillo como mezclar | ||||||||||||||||||||||||||||||||||||||||||||||||||
ELEMENTOS Y COMPUESTOS.......... SUSTANCIAS SIMPLES Y COMPUESTOS  La materia la podemos encontrar en la naturaleza en forma de sustancias puras y de mezclas. * Las sustancias puras son aquéllas cuya naturaleza y composición no varían sea cual sea su estado. Se dividen en dos grandes grupos: Elementos y Compuestos. - Elementos: Son sustancias puras que no pueden descomponerse en otras sustancias puras más sencillas por ningún procedimiento. Ejemplo: Todos los elementos de la tabla periódica: Oxígeno, hierro, carbono, sodio, cloro, cobre, etc. Se representan mediante su símbolo químico y se conocen 115 en la actualidad. Compuestos: Son sustancias puras que están constituidas por 2 ó más elementos combinados en proporciones fijas. Los compuestos se pueden descomponer mediante procedimientos químicos en los elementos que los constituyen. Ejemplo: Agua, de fórmula H2O, está constituida por los elementos hidrógeno (H) y oxígeno (O) y se puede descomponer en ellos mediante la acción de una corriente eléctrica (electrólisis). Los compuestos se representan mediante fórmulas químicas en las que se especifican los elementos que forman el compuesto y el número de átomos de cada uno de ellos que compone la molécula.Ejemplo: En el agua hay 2 átomos del elemento hidrógeno y 1 átomo del elemento oxígeno formando la molécula H2O.
Cuando una sustancia pura está formada por un solo tipo de elemento, se dice que es una sustancia simple. Esto ocurre cuando la molécula contiene varios átomos pero todos son del mismo elemento. Ejemplo: Oxígeno gaseoso (O2), ozono (O3), etc. Están constituidas sus moléculas por varios átomos del elemento oxígeno. 
EL ATOMO?...............QUE ES? Esta interesante pagina, nos ayudará a comprender mucho acerca de este mágico tema. Vamos juntos http://www.quimicaweb.net/grupo_trabajo_fyq3/tema4/index4.htm LA TABLA PERIODICA Y SU CONFIGURACION COMO LEER LA TABLA PERIODICA? | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
1. Observa y contesta Escribe las zonas del gráfico que corresponden a: |
Considera el elemento
¿Qué sabes de la Tabla Periódica?
| 1. ¿Quién fue el creador de la Tabla Periódica que usamos actualmente? | ||||
| 2. ¿En qué año publicó su Tabla Periódica? | ||||
| 3. Este mérito debiera compartirlo con el químico alemán... | ||||
| 4. ¿Cuántos grupos tiene la actual Tabla Periódica de la IUPAC? | ||||
| 5. ¿Cuántos períodos tiene la actual Tabla Periódica de la IUPAC? | ||||
| 6. ¿Qué elementos son líquidos a temperatura ambientede 25ºC? | ||||
| 7. ¿Qué elemento fue descubierto fuera de nuestro planeta? | ||||
| 8. En la Tabla los elementos se ordenan en horizontal en orden creciente de... | ||||
| 9. En la Tabla los elementos se ordenan en vertical por semejanza en sus... | ||||
| 10. ¿Cuál es el elemento más ligero que no se encontró en la Naturaleza? | ||||
BIENVENIDOS AL PORTAL TEMÁTICO DE LA BIBLIOTECA EPM |















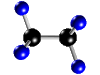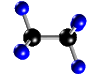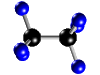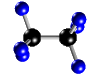



 La tabla periódica de elementos es uno de los instrumentos más importantes que ha inventado el hombre. En este documento, se reúne la mayor parte del conocimiento de la química.
La tabla periódica de elementos es uno de los instrumentos más importantes que ha inventado el hombre. En este documento, se reúne la mayor parte del conocimiento de la química. Este hecho, ha beneficiado a generaciones de estudiantes, ya que no sería fácil aprender las características de todos los elementos por separado. Sabiendo las características fundamentales de algunos elementos, es posible inferir la de los demás, separándolos en grupos o familias de acuerdo con la nomenclatura. Te invitamos a conocer un poco más sobre ella…
Este hecho, ha beneficiado a generaciones de estudiantes, ya que no sería fácil aprender las características de todos los elementos por separado. Sabiendo las características fundamentales de algunos elementos, es posible inferir la de los demás, separándolos en grupos o familias de acuerdo con la nomenclatura. Te invitamos a conocer un poco más sobre ella…
no me guusto :(
ResponderEliminarabordas demaciado el tema y aburre
ResponderEliminarme parece muy completo ;)
ResponderEliminaresta bien el contenido para apoyar a los alumnos en sus investigaciones
ResponderEliminar